Silvestre Acevedo, nacido el 26 de Abril del año 1980, de nacionalidad Venezolano
Técnico medio mención mecánica industrial, actualmente estudiando 3er semestre de Seguridad Industrial en el I.U.T Antonio Jose De Sucre.
La asignatura de TERMODINÁMICA esta con la tutora Ing. Ranielina Rondon Mejias.
Primera Ley de la TERMODINÁMICA
La primera ley de la termodinámica relaciona el trabajo y el calor transferido intercambiado en un sistema a través de una nueva variable termodinámica, la energía interna. Dicha energía ni se crea ni se destruye, sólo se transforma. En este apartado estudiaremos:
- Qué es la energía interna de un cuerpo
- El primer principio de la termodinámica
- El concepto de trabajo termodinámico
- Cómo extraer información útil de las gráficas presión - volumen
- Cuáles son los principales tipos de procesos termodinámicos
Energía interna
La energía interna de un sistema es una caracterización macroscópica de la energía microscópica de todas las partículas que lo componen. Un sistema está formado por gran cantidad de partículas en movimiento. Cada una de ellas posee:
- energía cinética, por el hecho de encontrarse a una determinada velocidad
- energía potencial gravitatoria, por el hecho de encontrarse en determinadas posiciones unas respecto de otras
- energía potencial elástica, por el hecho vibrar en el interior del sistema
Existen, además, otros tipos de energía asociadas a las partículas microscópicas tales como la energía química o la nuclear.
En definitiva, en el interior de un sistema conviven distintos tipos de energía, asociadas a las partículas microscópicas que los componen y que forman su energía interna.
La primera ley de la termodinámica establece una relación entre la energía interna del sistema y la energía que intercambia con el entorno en forma de calor o trabajo.
la Primera Ley de la Termodinámica como:
La primera ley de la termodinámica determina que la energía interna de un sistema aumenta cuando se le transfiere calor o se realiza un trabajo sobre él. Su expresión depende del criterio de signos para sistemas termodinámicos elegido:
Criterio IUPAC
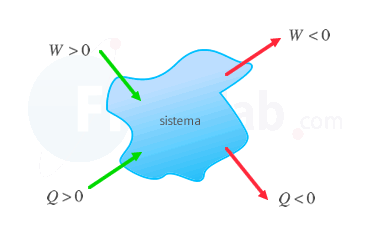
Se considera positivo aquello que aumenta la energía interna del sistema, o lo que es lo mismo, el trabajo recibido o el calor absorbido.
|
Criterio tradicional
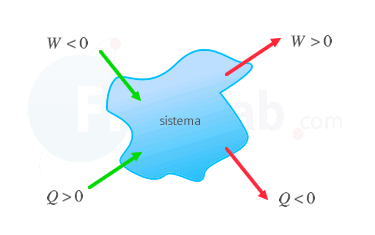
Se considera positivo el calor absorbido y el trabajo que realiza el sistema sobre el entorno.
|
Donde:
- ∆U : Incremento de energía interna del sistema ( ∆U = Ufinal - Uinicial ). Su unidad de medida en el Sistema Internacional es el julio ( J )
- Q : Calor intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se suele usar la caloría ( cal ). 1 cal = 4.184 J
- W : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
Al igual que todos los principios de la termodinámica, el primer principio se basa en sistemas en equilibrio.
Por otro lado, es probable que hayas oído más de una vez que la energía ni se crea ni se destruye, solo se transforma. Se trata del principio general de conservación de la energía. Pues bien, la primera ley de la termodinámica es la aplicación a procesos térmicos de este principio. En un sistema aislado, en el que no se intercambia energía con el exterior, nos queda:
El universo en su totalidad se podría considerar un sistema aislado, y por tanto, su energía total permanece constante.
Finalmente observa que, al ser una función de estado, la diferencia de energía interna solo depende de los estados inicial y final, ∆U = Uf- Ui , y no del camino que haya seguido el proceso. El calor y el trabajo, en cambio, no son funciones de estado, por lo que sus valores dependen del camino seguido por el proceso. Esto quedará bien ilustrado en los diagramas presión - volumen para gases ideales, como verás más abajo
Matemáticamente, el Primer Principio de la Termodinámica determina cómo afectan los intercambios de calor, Q, y trabajo, W, a la energía global de un sistema. Es por este motivo que latransferencia de energía en forma de calor y la transferencia de energía en forma de trabajo las hemos tratado en dos apartados previos de teoría.
Así, la ecuación matemática del Primer Principio es:
Trabajo termodinámico
La energía interna de un cuerpo no incluye la energía cinética global o potencial mecánica del mismo, tal y como señalamos anteriormente. Es por ello que no se ve alterada con el trabajo mecánico. En termodinámica nos interesa otro tipo de trabajo, capaz de variar la energía interna de los sistemas. Se trata del trabajo termodinámico.
Se denomina trabajo termodinámico a la transferencia de energía entre el sistema y el entorno por métodos que no dependen de la diferencia de temperaturas entre ambos. Es capaz de variar la energía interna del sistema.
Normalmente el trabajo termodinámico está asociado al movimiento de alguna parte del entorno, y resulta indiferente para su estudio si el sistema en sí está en movimiento o en reposo. Por ejemplo, cuando calientas un gas ideal en un recipiente con un pistón móvil en su parte superior, las partículas adquieren mayor energía cinética. Este aumento en la energía de las partículas se traduce en un aumento de la energía interna del sistema que, a su vez, puede traducirse en un desplazamiento del pistón. El estudio de este proceso desde el punto de vista de la termodinámica es independiente de si el sistema,como un todo, se encuentra en reposo o en movimiento, que sería una cuestión de mecánica. Sin embargo sí es cierto que, tal y como ocurre en una máquina de vapor, la energía de dicho trabajo termodinámico puede transformarse en energía mecánica.
TRABAJO TERMODINÁMICO PRESIÓN - VOLUMEN
El trabajo termodinámico más habitual tiene lugar cuando un sistema se comprime o se expande y se denomina trabajo presión - volumen (p - v). En este nivel educativo estudiaremos su expresión en procesos isobáricos o isobaros, que son aquellos que se desarrollan a presiónconstante.
El trabajo presión - volumen realizado por un sistema que se comprime o se expande a presión constante viene dado por la expresión:
Criterio IUPAC
 |
Criterio tradicional
 |
Donde:
- Wsistema : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- ∆V : Variación de volumen ( ∆V=Vf - Vi ). Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3 m3
Presta atención al signo del trabajo, realizado por el sistema, en función del criterio de signos.
- Criterio IUPAC
- Compresión Vi > Vf ⇒ Wsistema > 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema < 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
- Criterio tradicional
- Compresión Vi > Vf ⇒ Wsistema < 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema > 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
GRÁFICAS PRESIÓN - VOLUMEN
En el estudio del trabajo realizado por un sistema termodinámico con gases ideales es bastante común el uso de diagramas presión - volumen ( p - v ).
- Se representa el volumen V en el eje x
- Se representa la presión p en el eje y
- Se representa el proceso mediante una linea que une los puntos ( V ,p ) por los que este pasa entre el punto inicial ( Vi ,pi ) y el final ( Vf ,pf )
- Utilizaremos una flecha sobre la linea para indicar el sentido de la transformación termodinámica
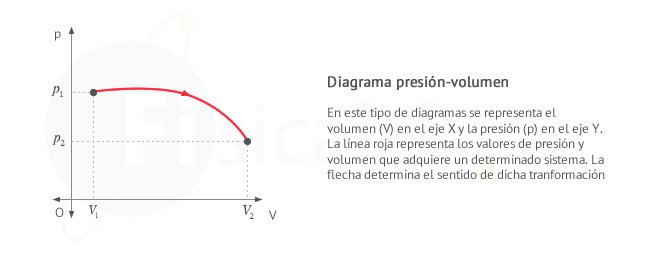
Las gráficas presión volumen nos sirven para calcular el trabajo realizado en un proceso en el que la presión no necesariamente tenga que ser constante.
El trabajo realizado por un sistema termodinámico coincide numéricamente con el area encerrada bajo la gráfica presión - volumen entre los valores de volumen inicial Vi y final Vf. El sentido de la flecha sobre la linea indica el signo del trabajo, según el criterio elegido
Criterio IUPAC
 |
Criterio tradicional
 |
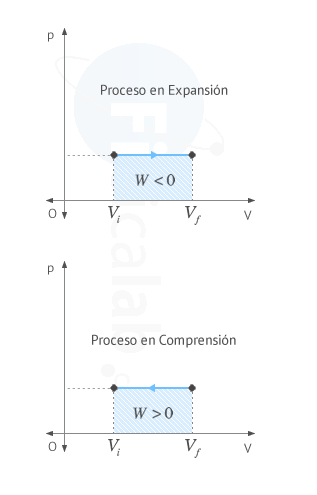 | 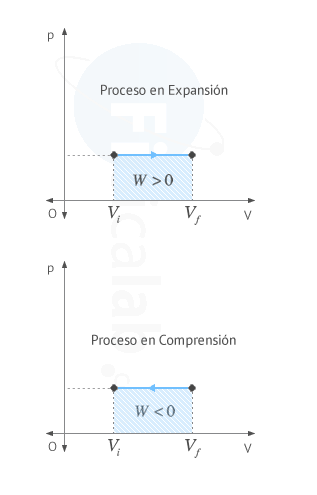 |
Observa que en un proceso cíclico el área encerrada por la curva se puede calcular como la resta entre el valor del área encerrada por la curva cuando el proceso se encuentra aumentando su volumen (en expansión) y el valor del área encerrada por la curva cuando el proceso se encuentra disminuyendo su volumen (en compresión), tal y como puede verse en la siguiente figura.
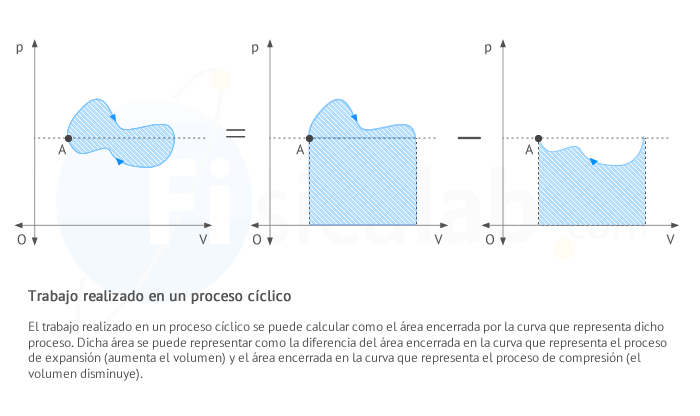
Interpretación de gráficas de gases ideales
Los diagramas presión volumen aportan gran cantidad de información, además de servir para el cálculo del trabajo realizado por el sistema. Vamos a particularizar en el caso de los gases ideales por ser su ecuación de estado p⋅V=n⋅R⋅T la más sencilla.
- Cada punto de la gráfica marca un estado del sistema. Las variables de estado para una determinada cantidad de gas, son la presión, el volumen y la temperatura. Un punto en la gráfica p - v tiene una única temperatura asociada, según la expresión
p⋅V=n⋅R⋅T⇒T=p⋅Vn⋅R , y por tanto cada punto marca un estado - Se puede demostrar que la energía interna U de un gas ideal depende únicamente de su temperatura. Así, a cada punto en la gráfica se le asocia, además de una temperatura, una energía interna.
- Se denominan isotermas a las lineas que representan igual temperatura. Siguen la expresión
pi⋅Vi=n⋅R⋅Ti=cte y corresponden con el conjunto de puntos que tienen, además, igual energía interna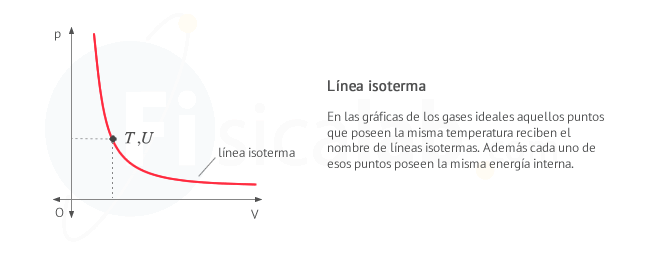
- Trabajo y calor dependen, en general, del camino seguido para llegar a un punto a otro de la gráfica, de la transformación.
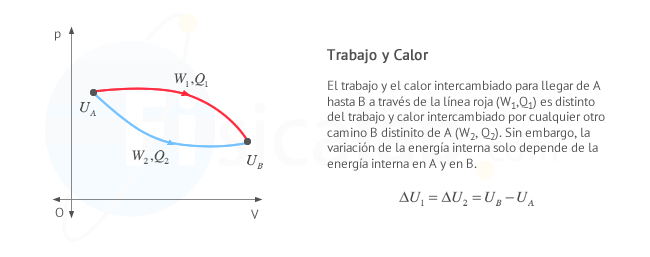
- En un proceso cíclico, la temperatura inicial y final es la misma, por tanto la energía interna del sistema no varía
∆U=Uf−Ui=0 , independientemente del camino seguido. Sin embargo recuerda que calor y trabajo intercambiados en el proceso no son funciones de estado y sí dependen, en general, del camino
- Para determinar el incremento de energía interna
∆U en cualquier tipo de proceso, se utiliza la expresión∆U=m⋅cv⋅∆T . ¿De donde viene? En un proceso a volumen constante (denominado proceso isocórico) no se realiza trabajo, pues el área bajo la curva del proceso es 0 y, en consecuencia, la primera ley de la termodinámica queda:
El calor recibido por un gas a volumen constante viene dado por la expresiónQ=m⋅cv⋅∆T . Combinando las dos expresiones anteriores, nos queda justamente la expresión buscada∆U=m⋅cv⋅∆T .Observa que, al depender el incremento de energía interna únicamente de los estados inicial y final (de la temperatura inicial y final), el valor obtenido será el mismo siempre que nos desplacemos a la misma isoterma, independientemente del camino seguido. Esto significa que, aunque el valor del incremento de energía se haya obtenido para un proceso a volumen constante, también será válido para cualquier proceso que se desplace a la misma isoterma. Puedes comprobarlo en este ejercicio.
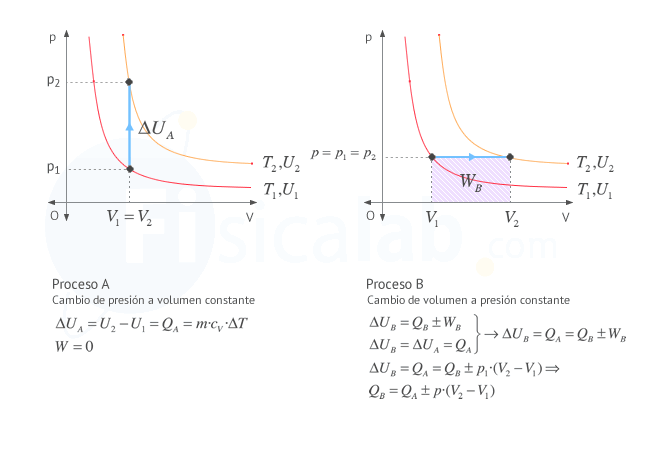
Como puedes observar en la figura si conocemos el incremento de energía interna en un proceso a volumen constante (proceso A), que experimentalmente es sencillo de determinar, se puede aplicar la primera ley de la termodinámica para conocer el trabajo el calor de otro proceso (proceso B) que termine en el mismo estado, o lo que es lo mismo, en la misma línea isoterma.
TIPOS DE PROCESOS
Los procesos termodinámicos se suelen clasificar en:
- Q = 0 Procesos adiabáticos. Aquellos en los que el sistema no intercambia calor. Por ejemplo, al usar un ambientador o desodorante en aerosol se produce un proceso casi adiabático. En estos casos
∆U=W (ó∆U=−W , según criterio de signos elegido), es decir, el trabajo es función de estado. Cuando comprimimos o expandimos un gas en un proceso en el que no se intercambia calor, variamos su energía interna y, por tanto, su temperatura - V = cte. Procesos isocóricos. Aquellos en los que el volumen permanece constante. Por ejemplo, una botella de champán metida en un recipiente con hielo. Al no haber variación de volumen, el trabajo del sistema es cero.
Wsistema=0 . Siguiendo el primer principio, nos queda∆U=Q , es decir, el calor es una función de estado. Esto significa que la única forma de variar la energía interna en un proceso en el que no se varía el volumen es a través del intercambio de calor - p = cte. Procesos isobáricos. Aquellos en los que la presión permanece constante. Por ejemplo, las reacciones químicas. El valor del trabajo se calcula a partir de la expresión
Wsistema=p⋅∆V óWsistema=−p⋅∆V , según criterio IUPAC o tradicional respectivamentePor otro lado, este tipo de procesos permiten definir una nueva variable de estado, la entalpía H. De manera que:
Donde, como ves, la expresión de la entalpía no depende del criterio de signos seguido para llegar a ella - T = cte. Procesos isotérmicos. Aquellos en los que la temperatura permanece constante. Por ejemplo, un recipiente con gas y un pistón en la zona superior, sumergido en un depósito calorífico a temperatura constante. Al ser la temperatura constante, la variación de energía interna es cero
∆U=0 y en consecuencia:
Donde se han tenido en cuenta los dos criterios de signos posibles. Observa que el proceso se realiza sobre una única isoterma: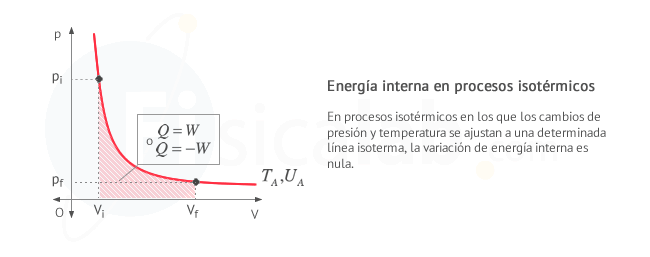
EJERCICOS RESUELTOS
Enunciado:
Se sitúan 15 L de gas ideal en un recipiente a 27 ºC. El recipiente cuenta con un pistón móvil libre de rozamiento. La presión en el exterior se mantiene constante a 750 mmHg. Determina, si se eleva la temperatura a 190 ºC:
- El trabajo realizado en el proceso
- La variación de energía interna que tiene lugar
- El calor transferido durante el mismo
- Representa el proceso en un diagrama presión - volumen ( p - V )
Datos : cv = 5·R/2 ; R = 8.31 J/ mol·K
Solución:
Datos
- Volumen inicial Vi = 15 L = 15·10-3 m3
- Temperatura inicial Ti = 27 ºC = 300.15 K
- Temperatura final Tf = 190 ºC = 463.15 K
- Presión constante p = 750 mmHg = 750·101325/760 = 99991.77 Pa
- Calor específico a volumen constante cv = 5·R/2
- Constante universal de los gases ideales R = 8.31 J/ mol·K
Consideraciones previas
- Usaremos el criterio de signos tradicional según el cual el trabajo es positivo se realiza contra el exterior
Resolución
1.
En los procesos a presión constante el trabajo termodinámico, según el criterio de signos establecido, viene dado por la expresión:
Para determinar el volumen final podemos aplicar la ecuación de estado de los gases ideales, de la siguiente manera:
La expresión anterior constituye la ley de Charles y Gay-Lussac. A partir de ella, nos queda:
Y volviendo a la expresión del trabajo termodinámico nos queda:
2.
Presta atención a este apartado por que vamos a utilizar una serie de conceptos que debes tener claros. En primer lugar, la variación de energía interna en un gas depende únicamente de la variación de temperatura. En el diagrama p - V de la figura puedes ver representadas las dos isotermas características del proceso.
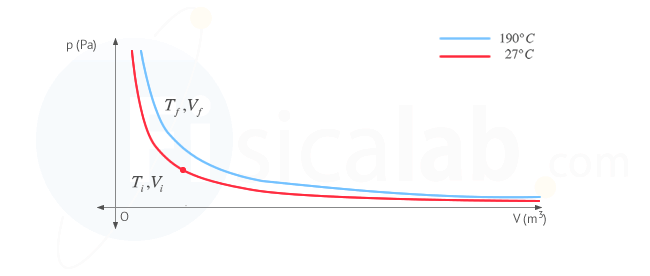
- Isoterma en rojo: es la de aquellos puntos genéricos ( V , p ) que se corresponden con una temperatura de 27 ºC. A todos ellos les corresponde una determinada energía interna del sistema
- Isoterma en azul: es la de aquellos puntos genéricos ( V , p ) que se corresponden con una temperatura de 190 ºC. A todos ellos les corresponde una determinada energía interna del sistema
En el proceso, al variar la temperatura varía la energía interna, es decir, nos desplazamos de una isoterma a otra realizando un determinado trabajo y transfiriendo un determinado calor. Independientemente de la forma en que nos desplacemos de una isoterma a otra (esto es, la cantidad de calor y trabajo que intervenga en el proceso), la variación de energía interna dependerá unicamente de la isoterma inicial y la isoterma final. Es por ello que, dado que nos dan como dato cv (calor específico a volumen constante), estudiaremos la variación de energía interna suponiendo un proceso isocórico ( a volumen constante ) donde el volumen no cambia y, por tanto, el desplazamiento de una isoterma a otra se realizaría exclusivamente mediante el intercambio de calor, al ser el trabajo realizado cero ( W = 0 ) . De esta forma, nos queda:
Por otro lado, dado que nos dan cv referida a cantidad de sustancia ( mol ), utilizaremos, para el cálculo del calor, la expresión:
Observa que ya habíamos presentado en teoría dicha expresión al hablar de la variación de energía interna de un gas cuando se incrementa la temperatura.
Para el cálculo de n aplicamos de nuevo la ecuación de estado de los gases ideales:
Finalmente, volviendo a la ecuación de la variación de energía interna en un proceso isocórico, tenemos:
En la siguiente figura se representa el proceso que tendría lugar a volumen constante y que nos sirve para determinar la variación de energía interna también en nuestro proceso a presión constante.
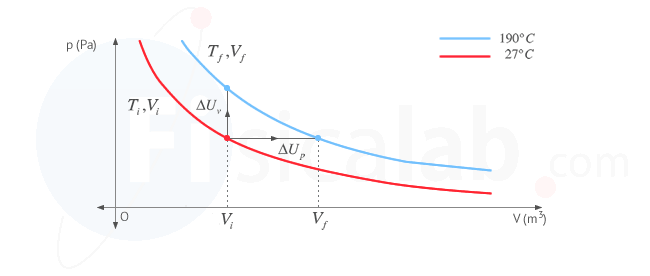
3.
Podemos aplicar la primera ley de la termodinámica para determinar el calor transferido en el proceso. Ten en cuenta que, tal y como hemos dicho en el punto 2, la variación de energía interna es igual a la que se experimenta en el proceso a volumen constante ya que las temperaturas inicial y final son las mismas: